In de Aerius calculator kunnen twee verschillende bronnen van Stikstof verbindingen worden ingevoerd. Dit zijn Stikstof Oxiden en Ammoniak. De invoereenheid hiervoor is Kg. Het is ook mogelijk om liters brandstof in te voeren maar deze worden door de calculator (afhankelijk van het motortype) omgerekend naar NOx.
Rekenen aan Stikstof
In de Aerius calculator worden de stikstof depositie uitkomsten uitgedrukt in mol. Mol is een vaste hoeveelheid deeltjes. De Achtergrond Waarde (AW) en de Kritische Depositie Waarde (KDW) worden uitgedrukt in mol Stikstof (symbool N) atomen. De depositie vindt fysiek plaats als ammoniak of NOx deeltjes maar rekentechnisch als N atomen. Het is mogelijk de Kg NOx verbindingen en de Kg ammoniak om te rekenen in mol. Allereerst is het belangrijk vast te stellen uit welke atomen NOx en Ammoniak bestaat. NOx is een verzamelnaam van NO (stikstof mono oxide) en NO2 (stikstof di oxide) verbindingen, de O staat voor zuurstof atomen. Beide verbindingen bevatten één N atoom. Ammoniak heeft als symbool NH3 en bevat naast drie waterstof (H) atomen eveneens één N atoom. 1 Kg ammoniak bevat 58,71 mol atomen. 1 kg NO bevat 33,33 mol N atomen en 1 kg NO2 bevat 21,73 mol N atomen. Ammoniak bevat (omdat waterstof lichter is dan zuurstof) relatief meer N atomen dan de NOx verbindingen en NO bevat weer meer dan NO2.
Verspreidingsgebied NOx en ammoniak vergeleken
Wij hebben een test berekening gemaakt met de Aerius calculator. Op een emissiepunt hebben we een emissiehoeveelheid van 10 Kg Ammoniak en 10 Kg NOx ingevoerd. In onze software is het mogelijk om te zien hoeveel N atomen afkomstig zijn van ammoniak en hoeveel N atomen afkomstig van NOx verbindingen en neerslaan per hexagoon. Uit de analyse blijkt dat het aandeel N atomen afkomstig van ammoniak voor 90% verantwoordelijk is voor de depositie in de directe omgeving. De stikstof atomen afkomstig van NOx verbindingen zijn goed voor de resterende 10%. Met andere woorden Ammoniak slaat dichter bij het emissiepunt neer dan NOx. Dit kan verklaard worden doordat ammoniak oplosbaar is in water en door regen maar ook de door de luchtvochtigheid neerdaalt op de bodem. NOx verbindingen zijn veel minder goed oplosbaar in water dan ammoniak en blijven daardoor langer in de lucht hangen en worden door de wind over een groter gebied verspreid. NOx kent dus een kleinere depositie vlakbij de emissiebron als ammoniak. In de onderstaande afbeelding wordt dit weergegeven.
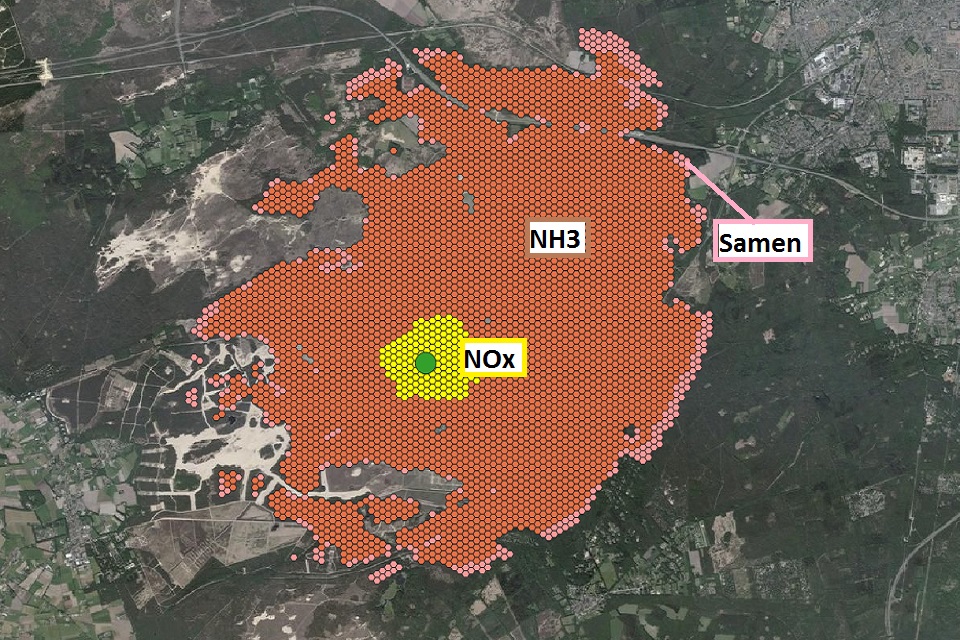
Het emissiepunt waarvandaan de 10 Kg Ammoniak en 10 Kg NOx wordt geëmitteerd is met een groene punt aangegeven. De NOx depositie tot de grenswaarde 0,01 mol is weergegeven met een gele vlek. De ammoniak depositie tot de grenswaarde 0,01 mol is weergegeven met een bruine vlek. Daarnaast is met een roze kleur de totale emissie weergegeven tot de grenswaarde. NOx vervliegt meer en verspreid zich dus over een groter gebied dan ammoniak. In de onderstaande afbeelding wordt dit nog een keer getalsmatige weergegeven rondom het emissiepunt. Het bovenste getal is de depositie van ammoniak, het middelste getal die van NOx en het onderste getal de totale emissie. Het emissiepunt is met groen aangegeven en de grens van waarbij de NOx onder de drempelwaarde ligt en naar ammoniak nog erboven is goed te zien.

Deze uitkomsten kunnen onder andere gebruikt worden voor intern en extern verrekenen. Het heeft een groter effect bij een interne verrekening om ammoniak te reduceren dan NOx. Daarnaast is bij het extern salderen aantrekkelijker om ammoniak te saneren dan NOx. Wij kunnen voor een project of plan gedetailleerde berekeningen maken waaruit blijkt wat de beste reductie methoden zijn. Het is daarnaast mogelijk ten behoeve van extern salderen een profiel te maken van de saldogever. Dit profiel kan dan worden gematcht met een of meerdere saldo ontvangers. Een bouwondernemer kan meerdere bouwprojecten bijvoorbeeld matchen middels extern salderen met een saldo gevende veehouder.
3d model stikstof depositie
Wij hebben om de NOx versus Ammoniak verspreidingsberekening inzichtelijk te maken een 3D model gemaakt. De hoogte in het model correspondeert met de hoogte van de totale (NOx en NH3) depositie. Dit model laat grafisch zien hoeveel depositie er direct rondom de bron plaatsvindt in relatie tot het verspreidingsgebied. In de onderstaande afbeelding wordt dit weergegeven.
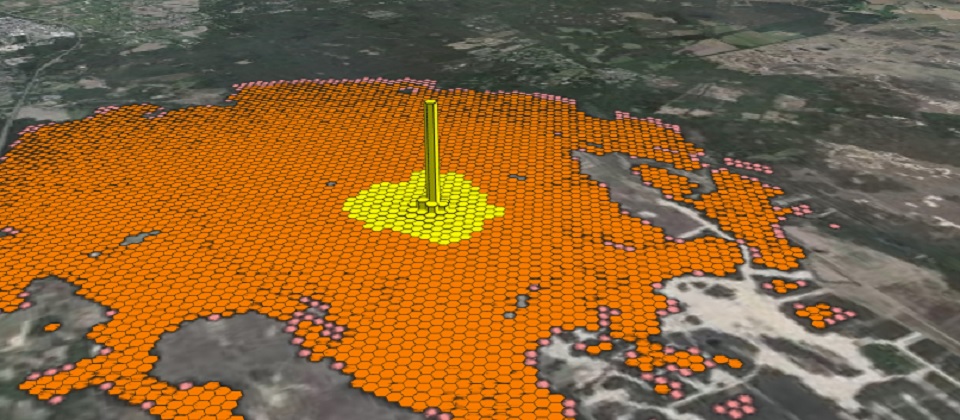
Uit de afbeelding blijkt dat de depositie het grootst is direct bij het emissiepunt. In deze voorbeeldberekening is de hoogste depositie 108,56 mol en loopt de depositie af naar de rand van het gebied naar een waarde 0,005 mol/ha/jaar.
Schadelijkheid NOx versus Ammoniak
Nu is er een levendige discussie over de schadelijkheid van NOx en Ammoniak in de natuur. Zijn beide stoffen even schadelijk of springt er een uit is daarbij de vraag? Om de schadelijkheid vast te stellen moet er onderscheid gemaakt worden in droge en natte depositie. Droge depositie is het zich verspreiden via de lucht en natte depositie is het uitregenen en uitdampen van stoffen in de lucht. NOx en Ammoniak maken in de lucht onderdeel uit van een groep stoffen waar zwaveloxides ook onderdeel van uitmaken. In de lucht reageren deze stoffen ook met elkaar en vormen ze een mengsel. NO wordt in de lucht bijvoorbeeld met zuurstof omgezet in NO₂. (2NO + O₂ → 2NO₂)
Droge depositie
De droge depositie van NOx en Ammoniak bestaat eruit dat de stoffen neerslaan op een blad van een plant of boom en via de huidmondjes opgenomen worden door de plant. Niet iedere plant is daar even goed in. Er zijn onderzoeken gedaan naar de NOx en Ammoniak opname van planten en Bomen. Dit onderzoek is hier en hier terug te vinden. Wij hebben echter nergens een vergelijking kunnen vinden die aantoont dat Ammoniak schadelijker is dan NOx voor een plant of boom als het via de huidmondjes wordt opgenomen. Wel staat vast dat overdaad schaad maar dat maakt nog niet dat de een schadelijker is dan de ander.
Natte depositie ammoniak
De natte depositie verloopt op een andere manier dan de droge depositie. Ammoniak wordt in de lucht of bodem of in het water voor een deel omgevormd tot ammonium. De reactie verloopt als volgt
NH3 + H+ → NH4+ (ammoniak met een waterstof ion vorm ammonium)
Deze reactie vindt in een Ph neutrale of zure omstandigheden plaats. De in de lucht aanwezige zwavelverbindingen vormen zwavelzuur wat zorgt voor zure omstandigheden die de vorming van ammonium bevorderen. Daarnaast is er ook nog een andere reactie met ammoniak mogelijk namelijk de vorming van nitriet. Hierbij wordt ammoniak of ammonium geoxideerd.
2NH3 + 3O₂ → 2 H+ + 2NO₂⁻ +2 H₂O (NO₂ wordt Nitriet genoemd en deze omvorming wordt nitrificatie genoemd). Daarmee is de reactie nog niet afgelopen.
2NO₂⁻ + O₂ → 2NO₃⁻ (NO₃ wordt Nitraat genoemd)
Beide stappen vinden plaats door bacteriën in de bodem of het water die deze reactie vergemakkelijken. Uit de bovenstaande reactie blijkt dus dat ammoniak uiteindelijke regeert tot nitraat. Hoe snel de reacties verlopen en in welke mate de omzetting plaatsvindt is afhankelijk van de aanwezigheid van zuurstof (wat nodig is voor de oxidatie) en de zuurgraad en de aanwezigheid van bacteriën.
Natte depositie NOx
Zoals aangegeven wordt NO in de lucht omgevormd tot NO₂. NO₂ regeert met water vervolgens tot salpeterzuur.
3NO₂ + H₂O → 2 H+ + NO₃⁻
NOx reageert uiteindelijk ook tot nitraat. Het resultaat van de reacties van zowel ammoniak als stikstofoxiden is uiteindelijk dezelfde stof nitraat. Nu zijn niet alle planten even gevoelig voor het gevormde nitraat. (Maar ook de andere in de tussenstappen gevormde stoffen zoals nitriet kunnen schadelijk zijn). De schadelijkheid van nitraat en de stoffen gevormd in de tussenstappen is dus afhankelijk van allereerst de hoeveelheid en daarnaast van de gevoeligheid van de plant.
Nu bestaat er ook nog denitrificatie. Daarbij wordt het gevormd nitraat omgezet in stikstof gas.
2 NO3− + 10e− + 2 H+ + 10 {H} → N2 + 6 H2O
Het uiteindelijke resultaat stikstofgas N₂ is een inert gas en niet schadelijk voor de natuur. Ook deze denitrificatie vindt plaats door bacteriën in de bodem of in het water.
De slotsom is dat er eigenlijk geen goede uitspraak mogelijk is of dat Ammoniak of NOx als stof schadelijker is voor de natuur. Omdat ammoniak meer N atomen per kilogram heeft dan NOx verbindingen (waterstof is namelijk veel lichter dan zuurstof) vormt er zich uiteindelijk meer nitraat en is 1 Kg ammoniak als gevolg daarvan schadelijker dan 1 kg NOx.